Tue 29 Nov 2005
Produksi Embrio Kembar Identik Melalui Bedah Mikro pada Embrio Kambing Hasil In Vitro
Posted by boediono under Jvet Vol 6(2) 2005(PRODUCTION OF MONOZYGOTIC TWINS OF IN VITRO PRODUCED GOAT EMBRYO BY EMBRYO SPLITTING)
ARIEF BOEDIONO
Laboratoriuim Embriologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor,
Jl. Agatis, Kampus IPB Darmaga, Bogor 16680. E-mail: [email protected]
ABSTRAK
Penelitian dilakukan untuk mengembangkan produksi embrio kembar identik pada kambing melalui teknik bedah mikro pada embrio hasil produksi fertilisasi in vitro. Produksi embrio secara in vitro dilakukan dengan melakukan fertlitisasi oosit yang telah matang dengan spermatozoa yang diseleksi dengan metode swim up. Kultur in vitro untuk mencapai tahap morula (hari ke-5) dan blastosis (hari ke-8) dilakukan dalam medium CR1aa. Produksi embrio kembar identik pada kambing tahap perkembangan morula dan blastosis dilakukan dengan metode bedah mikro (splitting) pada embrio yang diproduksi melalui teknologi fertilisasi in vitro. Pemotongan embrio-utuh dilakukan dengan metode sederhana tanpa menggunakan pipet holding dan pemotongan dilakukan menggunakan modifikasi pisau silet. Teknik pemotongan embrio kambing tahap morula relatif lebih mudah daripada tahap blastosis karena orientasi yang lebih mudah. Namun demikian viabilitas embrio-paruh pada kultur in vitro hasil pemotongan embrio tahap morula lebih rendah daripada embrio tahap blastosis. Keberhasilan pemotongan dengan orientasi ICM didapatkan tingkat keberhasilan yang tidak berbeda nyata.
Kata-kata kunci: embrio kambing, kultur in vitro, kembar identik, morula, blastosis
ABSTRACT
This study was designed to improve the production of monozygotic twins of in vitro produced goat embryo by embryo micro-surgery. The goat embryos were produced in vitro by fertilizing the matured oocytes with selected sperm using swim up method. Embryos were cultured in vitro in CR1aa medium up to morula (day-5) and blastocyst stages (day-8). The production of monozygotic twins embryos were done by embryo splitting (at morula and blastocysyt stages) with the simple method (without using holding pipette). The embryo splitting procedure at morula stage was relatively easier than that of blastocyst stage. However, the viability rate of demi-embryo after 3 or 24 hours cultured in vitro was higher in blastocyst than in morula. According to the ICM present in demi-embryos, overall results shows that the success rate of embryo splitting at the morula and blastocyct stages was similar.
Key words: Goat embryo, in vitro culture, monozygotic twins, morula, blastocyst.
PENDAHULUAN
Perkembangan bioteknologi reproduksi pada dekade terakhir menjadi topik ilmiah yang sangat penting. Pada sektor peternakan, aplikasi bioteknologi yang telah dikembangkan antara lain Inseminasi Buatan (IB) dan Transfer Embrio (TE). Salah satu upaya untuk meningkatkan daya guna teknologi TE adalah pemanfaatan teknologi produksi embrio secara in vitro dan perekayasaan embrio dengan tujuan untuk optimalisasi bibit unggul.
Banyak laboratorium yang telah berhasil memproduksi embrio sapi baik secara in vivo maupun in vitro. Namun demikian informasi mengenai produksi embrio pada kambing khususnya dengan teknik fertilisasi in vitro (FIV) masih relatif sedikit. Teknik FIV pada mamalia merupakan suatu rangkaian proses yang terdiri dari koleksi dan maturasi oosit dan spermatozoa, fertilisasi serta kultur secara in vitro. Dengan pengetahuan mengenai kondisi optimum dari sistem maturasi sel gamet dan fertilisasi akan didapatkan tingkat fertilisasi yang tinggi untuk dikembangkan sampai tahap blastosis.
Zigot merupakan hasil penggabungan pronukleus jantan dan betina selanjutnya akan membelah (cleavage). Selama awal pembelahan terjadi penambahan kecepatan metabolisme yang relatif kecil dan akan meningkat dengan tajam pada tahap morula dan blastosis (Hafez dan Hafez, 2000). Tahapan yang penting dalam proses pembelahan embrio mamalia adalah pada saat terjadinya kompaksi antar sel anak (blastomer) hasil pembelahan. Proses kompaksi sangat penting untuk diferensiasi sel blatomer menjadi trofoblas, inner cell mass (ICM) dan pembentukan blastosul (Van Soom et al., 1992).
Kemajuan Bioteknologi khususnya di bidang reproduksi telah berhasil meniru kejadian kembar identik (kembar monozigotik) yang secara alamiah dapat terjadi pada mamalia. Keberhasilan tersebut merupakan suatu terobosan dalam mengoptimalkan embrio kualitas unggul. Selain itu, produksi hewan kembar identik sangat bermanfaat dalam mempelajari perkembangan embrio (Rands, 1985), peningkatan jumlah embrio per koleksi (Leibo dan Rall, 1987) serta memperkecil jumlah hewan untuk penelitian karena mempunyai sifat genetik yang sama dengan kawan kembarnya (Sreenan, 1983; Biggers, 1986). Rekayasa embrio dengan hasil embrio kembar identik juga bertujuan untuk mendapatkan dua keturunan yang sama dari satu embrio-utuh sehingga didapatkan keberhasilan embrio transfer lebih tinggi (Willadsen dan Godke, 1984).
Tujuan dari penelitian ini adalah untuk meningkatkan potensi embrio hasil produksi in vitro melalalui teknologi bedah mikro untuk mendapatkan embrio-paruh sebagai upaya mendapatkan embrio kembar identik.
BAHAN DAN METODE
Metode fertilisasi in vitro yang digunakan untuk produksi embrio dengan fertilisasi adalah sesuai dengan metode yang telah dilakukan sebelumnya oleh Boediono et al. (2000).
Koleksi dan Maturasi Oosit:
Ovari kambing diambil dari rumah potong hewan dalam medium NaCl fisiologis pada suhu 30oC. Koleksi oosit dilakukan dengan cara aspirasi oosit dari folikel berukuran diameter antara 2-5 mm menggunakan jarum berukuran 20G yang dihubungkan dengan spuit 5 ml yang sebelumnya telah diisi 0,5 ml larutan modifikasi phosphate buffered saline (mPBS). Oosit hasil koleksi kemudian dicuci tiga kali dan dikultur in vitro dalam medium maturasi yang terdiri dari CR1aa yang ditambahkan dengan serum kambing 10%, folicle stimulating hormone (FSH; Denka, Kawasaki, Japan) 0,01 mg/ml dan gentamicin sulfat (Sigma, USA) 50 g/ml. Maturasi oosit secara in vitro dilakukan dalam inkubator CO2 5% dengan suhu 38,5oC dengan periode inkubasi 24 jam.
Fertilisasi In Vitro:
Spermatozoa yang digunakan untuk penelitian ini adalah spermatozoa segar. Spermatozoa segar dikoleksi dari pejantan dengan menggunakan vagina buatan. Seleksi spermatozoa motil yang akan digunakan untuk fertilisasi in vitro dilakukan dengan modifikasi metode swim up seperti yang pernah dilaporkan oleh Purvis dan Egdetveit (1993). Spermatozoa dicuci dengan sentrifugasi sebanyak dua kali masing-masing dengan kecepatan 500G selama lima menit dalam larutan CR1aa yang telah ditambahkan kafein (Sigma, USA) 2,5 mM (Younis, et al., 1991). Spermatozoa hasil pencucian ditambahkan dengan medium yang sama sebanyak 1 ml dan diinkubasi dalam inkubator CO2 5% dengan suhu 38,5oC selama 1 jam untuk memberi kesempatan spermatozoa motil berenang ke atas. Hanya spermatozoa yang dapat berenang ke atas yang digunakan untuk fertilisasi in vitro dengan konsentrasi 2,5 x 106 spermatozoa/ml.
Oosit yang telah matang, dicuci dalam medium fertilisasi (Kaf-CR1aa) sebanyak 3 kali kemudian dilakukan fertilisasi dalam medium drop/tetes sebanyak 100 l berisi sebanyak 20-30 oosit per drop. Fertilisasi in vitro dilakukan selama 18 jam dalam inkubator CO2 5% dengan suhu 38,5oC.
Perkembangan Embrio In vitro:
Zigot hasil fertilisasi in vitro dicuci dari medium inseminasi untuk selanjutnya dilakukan kultur dalam medium CR1aa dengan penambahan insulin (Sigma, USA) 5 g/ml, gentamicin sulfat 50 g/ml dan serum kambing sebanyak 10% sampai perkembangan embrio hari kelima (tahap morula) dan hari kedelapan tahap blastosis (Gambar 1).
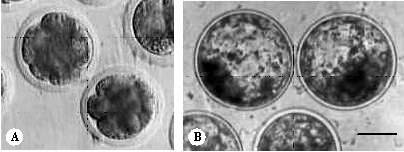
Gambar 1. Embrio kambing hasil produksi in vitro. (A) pada tahap perkembangan morula dan (B) blastosis. Bar: 50 µm.
Bedah Mikro Embrio:
Embrio tahap morula atau blastosis hasil perkembangan in vitro digunakan untuk pembuatan kembar identik dengan metode bedah mikro. Pisau mikro yang digunakan juga merupakan pisau mikro modifikasi yang dibuat dengan memanfaatkan pisau silet yang terbuat dari baja. Pisau mikro dibuat dengan mematahkan bagian ujung pisau silet menggunakan tang mulut buaya sehingga didapatkan potongan unjung silet yang tajam. Setelah dilakukan sterilisasi dengan panas, potongan pisau mikro dilekatkan pada pipa kapiler (Narishige, Japan) yang sudah dibentuk sesuai dengan keperluan menggunakan perekat yang kuat.
Bedah mikro embrio dilakukan dengan metode sederhana dengan memotong sekaligus zona pellusida dan blastomer menggunakan pisau mikro (micro blade) tanpa mengunakan pipet holding seperti yang dilaporkan oleh Nowshari dan Holtz (1993) dengan beberapa modifikasi. Bedah mikro embrio dilakukan di bawah mikroskop inverted (Nikon, Japan) yang dilengkapi dengan perangkat manipulasi mikro (Narishige, Japan). Pemotongan embrio dilakukan dalam 10 ul drop medium mPBS(-) untuk satu embrio-utuh per drop pada cawan petri (Falcon 1006, USA) yang ditambahkan mineral oil (Sigma, USA) diatasnya untuk mencegah penguapan medium. Untuk ketepatan orientasi pemotongan dan mencegah embrio bergerak (menggelinding) dibuat goresan terdahulu pada cawan petri. Pemotongan embrio dilakukan dengan menempatkan embrio diatas goresan yang telah dibuat dengan harapan bisa didapatkan embrio-paruh yang sama besarnya. Pemotongan embrio tahap morula dapat dilakukan pada semua posisi, sedangkan pada embrio blastosis pemotongan harus berorientasi pada ICM dan trofoblas sehingga didapatkan embrio-paruh yang masing-masing mempunyai ICM dan trofoblas yang berkembang (Gambar 2). Embrio-paruh hasil pemotongan dicuci dalam medium kultur CR1aa untuk kemudian dikultur kembali secara in vitro dalam inkubator CO2 5% pada suhu 38,5oC.
Gambar 2. Pembuatan kembar identik dengan metode bedah mikro pada blastosis kambing. (A) Goresan pada dasar cawan petri sebagai tempat orientasi ICM dan trofoblas, (B) Awal penyayatan dengan orientasi ICM dan trofoblas, (C) Embrio-paruh (kembar identik) setelah penyayatan dan kultur in vitro selama 3 jam. Bar: 50 µm.
Viabilitas Embrio-paruh:
Keberhasilan pemotongan embrio baik tahap morula maupun blastosis dilakukan dengan pengamatan embrio-paruh hasil pemotongan 1 jam setelah pemotongan dengan melihat morfologi embrio-paruh. Pengamatan selanjutnya untuk melihat viabilitas embrio-paruh dilakukan 24 jam setelah pemotongan pada embrio tahap morula sehingga diharapkan embrio akan berkembang mencapai tahap blastosis. Sedangkan pada pemotongan embrio tahap blastosis pengamatan dilakukan 3 jam setelah pemotongan. Evaluasi dilakukan dengan melihat kemampuan embrio-paruh untuk membentuk kembali blastosul yang rusak akibat pemotongan.
HASIL DAN PEMBAHASAN
Hasil produksi embrio kambing secara in vitro digunakan untuk manipulasi bedah mikro dalam upaya penggandaan embrio dengan pembuatan kembar identik. Bedah mikro dilakukan pada 81 embrio-utuh (tahap morula dan blastosis) dan dihasilkan 149 embrio-paruh dengan tingkat keberhasilan 92,0% (Tabel 1).
Tabel 1. Keberhasilan Pemotongan Embrio Kambing dengan Bedah Mikro dan Viabilitas Embrio-paruh pada Kultur In Vitro
Pada kolom yang sama perbedaan huruf menunjukkan perbedaan yang nyata (a-b, P * Pengamatan dilakukan 3 jam setelah pemotongan embrio tahap blastosis dan 24 jam setelah pemotongan embrio tahap morula.
Tahapan embrio-utuh yang direkayasa akan menentukan keberhasilan embrio-paruh yang dihasilkan untuk tumbuh kembali setelah kultur in vitro. Viabilitas embrio-paruh setelah bedah mikro menunjukkan bahwa manipulasi embrio (untuk mendapatkan kembar identik) tahap blastosis didapatkan hasil yang lebih baik daripada tahap morula. Pada satu jam pengamatan setelah bedah mikro didapatkan kemampuan hidup yang lebih tinggi pada manipulasi embrio tahap blastosis (89,7%) lebih baik (P Pemotongan embrio dengan metode bedah mikro merupakan upaya secara mekanik untuk membelah embrio tahap perkembangan awal meniru kejadian kembar identik yang bisa terjadi secara alamiah. Pembuatan embrio kembar identik sangat tergantung dari keberhasilan bedah mikro dengan menghasilkan embrio-paruh dengan komposisi trofoblas dan ICM yang lengkap. Dari 124 embrio yang diperoleh dengan bedah mikro didapatkan 110 (88,7%) embrio-paruh dengan ICM dan trofoblas yang lengkap dan sebanyak 14 (11,3%) embrio-paruh tanpa ICM (Tabel 2). Hanya embrio-paruh dengan ICM dan trofoblas yang lengkap yang akan mampu berkembang menjadi individu normal. Untuk mendapatkan kembar identik, ICM sebagai sel utama mutlak harus terdapat pada masing-masing embrio-paruh hasil pemotongan. Tanpa ICM, implantasi masih memungkinkan terjadi namun fetus yang berasal dari ICM tidak akan berkembang.
Tabel 2. Keberhasilan Pemotongan Embrio Kambing dengan ICM sebagai Orientasi
Pada kolom yang sama huruf yang sama tidak menunjukkan perbedaan yang nyata (P>0,05)
Orientasi ICM pada saat bedah mikro perlu diperhatikan pada saat rekayasa menggunakan embrio tahap blastosis karena pada tahapan tersebut blastomer sudah terdeferensiasi menjadi sel utama (ICM) yang bertanggung jawab membentuk fetus dan sel penunjang (trofoblas) yang bertanggung jawab membentuk plasenta (Willadsen, 1979). Namun demikian bila bedah mikro untuk mendapatkan kembar identik dilakukan pada tahap morula, orientasi tersebut tidak diperlukan karena pada tahapan tersebut belum terjadi deferensiasi sel. Pemotongan embrio tahap morula relatif lebih mudah dibandingkan tahap blastosis pada embrio kambing. Hasil yang diperoleh sependapat dengan yang dilaporkan oleh Williams et al. (1984) dan Rho et al. (1998) pada pemotongan embrio sapi.
Viabilitas embrio-paruh pada kultur in vitro menunjukkan angka yang relatif lebih rendah pada pemotongan embrio tahap morula dibandingkan tahap blastosis, walaupun secara statistik tidak berbeda nyata. Hasil serupa juga dilaporkan oleh peneliti terdahulu (Tsunoda et al., 1985; Nowshari dan Holtz, 1993) bahwa viabilitas embrio-paruh hasil pemotongan embrio tahap morula lebih rendah dibandingkan embrio-paruh hasil pemotongan embrio tahap blastosis. Hal tersebut disebabkan oleh beberapa hal antara lain: 1) Jumlah sel embrio tahap morula lebih sedikit daripada tahap blastosis. Kerusakan fisik sebagai akibat proses pemotongan embrio akan mengakibatkan berkurangnya jumlah blastomer, 2) Hubungan antar sel yang terdapat pada embrio tahap morula lebih longgar dari pada tahap blastosis. Kemungkinan terjadi pelepasan ikatan antar blastomer pada proses pemotongan embrio tahap morula akan lebih besar dibandingkan embrio tahap blastosis, 3) Teknik pemotongan untuk menghasilkan embrio-paruh yang tidak sama besar dan beberapa hal lain yang berkaitan dengan hal tersebut. Dapat dikatakan bahwa tahap blastosis merupakan tahap yang lebih baik untuk pemotongan embrio dalam rangka produksi embrio kembar identik. Hal yang sama dilaporkan pada produksi kembar identik pada babi (Tao et al., 1995), kambing (Tsunoda et al., 1985) dan domba (Chesne et al., 1987; Shelton, 1992).
Keberhasilan pemotongan dilihat dari morfologi embrio-paruh setelah pemotongan dengan metode yang dikembangkan dalam penelitian ini tidak berbeda bila dilakukan pada tahap morula dan blastosis. Pemotongan dilakukan secara langsung dengan memotong zona pelusida dan blastomer sekaligus dan selanjutnya dikultur secara in vitro tanpa zona pelusida. Pemilihan embrio tahap perkembangan morula dan blastosis untuk produksi embrio kembar identik didasarkan bahwa pada tahap tersebut embrio telah mengalami kompaksi sehingga untuk perkembangan selanjutnya dalam kondisi in vitro tidak diperlukan keberadaan zona pelusida (Boediono et al., 1993; Boediono et al., 1995).
KESIMPULAN
Dari hasil penelitian ini dapat diambil kesimpulan bahwa teknik pemotongan embrio kambing tahap morula relatif lebih mudah daripada tahap blastosis karena orientasi yang lebih mudah. Namun demikian viabilitas embrio-paruh pada kultur in vitro hasil pemotongan embrio tahap morula lebih rendah daripada embrio tahap blastosis. Keberhasilan pemotongan dengan orientasi ICM didapatkan tingkat keberhasilan yang hampir sama.
UCAPAN TERIMA KASIH:
Penelitian ini dibiayai oleh Proyek Peningkatan Penelitian dan Pengabdian pada Masyarakat kontrak nomor: 011/P21PT/DPPM/20/PHB/VII/3/V/2000, Direktorat Pembinaan Penelitian dan Pengabdian pada Masyarakat DirJen Dikti DIKNAS.
DAFTAR PUSTAKA
Biggers, J.D. 1986. Pioneering mammalian embryo culture. In: Bavister (ed) The mammalian preimplantation Embryo. Regulation of growth and differentiation In Vitro. Plenum Press. New York. Pp 1-22.
Boediono, A., M. Ooe, M. Yamamoto, M. Takagi, S. Saha, and T. Suzuki. 1993. Production of chimeric calves by aggregation of in vitro fertilized bovine embryos without zonae pellucidae. Theriogeneology, 40:1221-1230.
Boediono, A., S. Saha, C. Sumantri, and T. Suzuki. 1995. Development in vitro and in vivo of aggregated parthenogenetic bovine embryos. Reprod. Fertil. Dev., 7:1073-1079.
Boediono, A., Y. Rusiyantono, K. Mohamad, I. Djuwita, dan Herliatien. 2000. Perkembangan oosit kambing setelah maturasi, fertilisasi dan kultur in vitro. Media Veteriner, 7(4):11-17.
Chesne, P., G. Colas, Y. Cognie, Y. Guerin, and C. Sevellec. 1987. Lamb production using superovulation, embryo bisection, and transfer. Theriogenology, 27:751-757.
Hafez, E.S.E., and B. Hafez. 2000. Reproduction in farm animals. 7th Ed. Lea&Febiger. Philadelphia. 509 pp.
Heyman, Y. 1985. Factors affecting the survival of whole and half-embryos transferred in cattle. Theriogenology, 23:63-75.
Leibo, S.P., and W.F. Rall. 1987. Increase in the production and pregnancy by bisection of bovine embryos. Theriogenology, 27:245 (Abstr.).
Nowshari MA and Holtz W. 1993. Transfer of split goat embryos without zonae pellucidae either fresh or after freezing. J. Anim. Sci., 71:3403-3408.
Purvis, K., and I. Egdetveit. 1993. Factors affecting sperm yield during swimp-up. J Assist Reprod Gen, 10:145-150.
Rands, G.F. 1985. Cell allocation in half and quadriple-sized preimplantation mouse embryos. J Exp Zool, 236:67-70.
Reichelt, B., and H. Niemann. 1994. Generation of twin piglets following bisection of embryos at the morula and blastocyst stage. J Reprod Fertil, 100:163-172.
Rho, G.J., W.H. Johnson, and K.J. Betteridge. 1998. Cellular composition and viability of demi- and quarter-embryos made from bisected bovine morulae and blastocysts produced in vitro. Theriogenology, 50:885-895.
Shelton, J.N. 1992. Factors affecting viability of fresh and frozen-thawed sheep demi-embryos. Theriogenology, 37:713-721.
Sreenan, J.M. 1983. Embryo transfer procedure and its use as a research technique. Vet Rec, 112:494-500.
Tao, T., B. Reichelt, and H. Niemann. 1995. Ratio of inner cell mass and trophoblastic cells in demi- and intact pig embryos. J. Reprod. Fertil., 104:251-258.
Tsunoda, Y., T. Tokunaga, T. Sugie, and M. Katsumata. 1985. Production of monozygotic twins following the transfer of bisected embryos in the goats. Theriogenology, 24:337-343.
Van Soom, A., V. Van Vlanenderen, A.R. Mahmoudzadeh, H. Deluyker, and A. de Kruif. 1992. Compaction rate of in vitro fertilized bovine embryos related to the interval from insemination to first cleavage. Theriogenology, 38:905-919.
Willadsen, S.M., and R.A. Godke. 1984. A simplified procedure for the production of identical sheep twins. Vet. Rec., 114:240-243.
Willadsen, S.M. 1979. A method for culture of micromanipulated sheep embryos and its use to produce monozygotic twins. Nature, 277:298-300.
Williams, T.J., R.P. Elsden, and G.E. Seidel Jr. 1984. Pregnancy rate with bisected bovine embryos. Theriogenology, 22:521-531.
Younis, A.I., K.A. Zuelke, K.M. Harper, M.A.L. Oliveira, and B.G. Brackett. 1991. In vitro fertilization of goat oocytes. Biol Reprod. 44:1177-1182.
January 6th, 2006 at 9:23 pm
saya amat tertarik dengan penyelidikan tentang kaedah saudara mensenyawakan embio kambing untuk melahirkan kembar seiras.saya merupakan penternak kambing di malaysia dan amat-amat memerlukan kepakaran saudara bagi membantu saya mengembangkan usaha menternak kambing saya pada masa hadapan.
February 7th, 2006 at 7:51 pm
PeneLLitian tntang ilmu biologi memang sangat menarik utuk di selidiki/didalmmi secara serius jadi saya amat mensupport usaha anda dalam mengadadkan riset untuk membuktikan, dan terimakasih karena anda telah membagi ilmu anda lewat jalur on-Line sehingga saya dan pembaca lain dadpat mengetahui perkembangan ilmu tentang bioteknologi makasih yup’s da tetap kaji terus ilmu iologi i will suport you From HERE ok.
and you will to ffaith for future go bioteknologi …From: Indoesia
July 13th, 2006 at 9:52 pm
luar biasa ternyata teknologi dibidang peternakan di Indonesia maju pesat, saya harap teknologi semacam ini bisa diaplikasikan demi kesejahteraan bangsa Indonesia.
August 4th, 2006 at 10:45 pm
thanks udah ngebantuin gw ngerjain tugas biologi,,
gbu
August 24th, 2006 at 2:50 pm
makasih, yu tlh memberikan inspirasi buat saya dalam mengerjakan skripsiku